Внутримитохондриальное окисление. Окислительное фосфорилирование. Компоненты цепи окислительного фосфорилирования Окислительное фосфорилирование кратко
14.1.1. В пируватдегидрогеназной реакции и в цикле Кребса происходит дегидрирование (окисление) субстратов (пируват, изоцитрат, α-кетоглутарат, сукцинат, малат). В результате этих реакций образуются НАДН и ФАДН2 . Эти восстановленные формы коферментов окисляются в митохондриальной дыхательной цепи. Окисление НАДН и ФАДН2 , протекающее сопряжённо с синтезом АТФ из АДФ и Н3 РО4 называется окислительным фосфорилированием .
Схема строения митохондрии показана на рисунке 14.1. Митохондрии представляют собой внутриклеточные органеллы, имеющие две мембраны: наружную (1) и внутреннюю (2). Внутренняя митохондриальная мембрана образует многочисленные складки - кристы (3). Пространство, ограниченное внутренней митохондриальной мембраной, носит название матрикс (4), пространство, ограниченное наружной и внутренней мембранами, - межмембранное пространство (5).
Рисунок 14.1. Схема строения митохондрии.
14.1.2. Дыхательная цепь - последовательная цепь ферментов, осуществляющая перенос ионов водорода и электронов от окисляемых субстратов к молекулярному кислороду - конечному акцептору водорода. В ходе этих реакций выделение энергии происходит постепенно, небольшими порциями, и она может быть аккумулирована в форме АТФ. Локализация ферментов дыхательной цепи - внутренняя митохондриальная мембрана.
Дыхательная цепь включает четыре мультиферментных комплекса (рисунок 14.2).

Рисунок 14.2. Ферментные комплексы дыхательной цепи (обозначены участки сопряжения окисления и фосфорилирования):
I. НАДН-KoQ-редуктаза (содержит промежуточные акцепторы водорода: флавинмононуклеотид и железосерные белки). II. Сукцинат-KoQ-редуктаза (содержит промежуточные акцепторы водорода: ФАД и железосерные белки). III. KoQН2 -цитохром с-редуктаза (содержит акцепторы электронов: цитохромы b и с1 , железосерные белки). IV. Цитохром с-оксидаза (содержит акцепторы электронов: цитохромы а и а3 , ионы меди Cu2+ ).14.1.3. В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с.
Убихинон (KoQ) - жирорастворимое витаминоподобное вещество, способен легко диффундировать в гидрофобной фазе внутренней мембраны митохондрий. Биологическая роль коэнзима Q - перенос электронов в дыхательной цепи от флавопротеинов (комплексы I и II) к цитохромам (комплекс III).
Цитохром с - сложный белок, хромопротеин, простетическая группа которого - гем - содержит железо с переменной валентностью (Fe3+ в окисленной форме и Fe2+ в восстановленной форме). Цитохром с является водорастворимым соединением и располагается на периферии внутренней митохондриальной мембраны в гидрофильной фазе. Биологическая роль цитохрома с - перенос электронов в дыхательной цепи от комплекса III к комплексу IV.14.1.4. Промежуточные переносчики электронов в дыхательной цепи расположены в соответствии с их окислительно-восстановительными потенциалами. В этой последовательности способность отдавать электроны (окисляться) убывает, а способность присоединять электроны (восстанавливаться) возрастает. Наибольшей способности отдавать электроны обладает НАДН, наибольшей способностью присоединять электроны - молекулярный кислород.
На рисунке 14.3 представлено строение реакционноспособного участка некоторых промежуточных переносчиков протонов и электронов в окисленной и восстановленной форме и их взаимопревращение.



Рисунок 14.3. Взаимопревращения окисленных и восстановленных форм промежуточных переносчиков электронов и протонов.
14.1.5. Механизм синтеза АТФ описывает хемиосмотическая теория (автор - П. Митчелл). Согласно этой теории, компоненты дыхательной цепи, расположенные во внутренней митохондриальной мембране, в ходе переноса электронов могут «захватывать» протоны из матрикса митохондрий и передавать их в межмембранное пространство. При этом наружная поверхность внутренней мембраны приобретает положительный заряд, а внутренняя - отрицательный, т.е. создаётся градиент концентрации протонов с более кислым значением рН снаружи. Так возникает трансмембранный потенциал (ΔµН+ ). Существует три участка дыхательной цепи, на которых он образуется. Эти участки соответствуют I, III и IV комплексам цепи переноса электронов (рисунок 14.4).

Рисунок 14.4. Расположение ферментов дыхательной цепи и АТФ-синтетазы во внутренней мембране митохондрий.
Протоны, выведенные в межмембранное пространство за счёт энергии переноса электронов, снова переходят в митохондриальный матрикс. Этот процесс осуществляется ферментом Н+ -зависимой АТФ-синтетазой (Н+ -АТФ-азой). Фермент состоит из двух частей (см. рисунок 10.4): водорастворимой каталитической части (F1 ) и погружённого в мембрану протонного канала (F0 ). Переход ионов Н+ из области с более высокой в область с более низкой их концентрацией сопровождается выделением свободной энергии, за счёт которой синтезируется АТФ.
14.1.6. Энергия, аккумулированная в форме АТФ, используется в организме для обеспечения разнообразных биохимических и физиологических процессов. Запомните основные примеры использования энергии АТФ:
1) синтез сложных химических веществ из более простых (реакции анаболизма); 2) сокращение мышц (механическая работа); 3) образование трансмембранных биопотенциалов; 4) активный транспорт веществ через биологические мембраны.Окислительное фосфорилирование - один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений - белки, жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий.
Однако чаще всего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для питания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания. Окисление глюкозы подразделяется на 3 этапа:
- 1. гликолиз;
- 2. окислительное декарбоксилирование и цикл Кребса;
- 3. окислительное фосфорилирование.
При этом гликолиз является общей фазой для аэробного и анаэробного дыхания .
2.1.1 Гликолиз - ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных .
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить на два этапа. Первый этап, протекающий с расходом энергии 2-х молекул АТФ, заключается в расщеплении молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся синтезом АТФ. Сам по себе гликолиз является полностью анаэробным процессом, то есть не требует для протекания реакций присутствия кислорода.
Гликолиз - один из древнейших метаболических процессов, известный почти у всех живых организмов. Предположительно гликолиз появился более 3,5 млрд. лет назад у первичных прокариот .
Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД H.
Полное уравнение гликолиза имеет вид:
С 6 Н 12 О 6 + 2НАД + + 2АДФ + 2Ф н = 2НАД Н + 2ПВК + 2АТФ + 2H 2 O + 2Н + .
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
С 6 Н 12 О 6 + 2АДФ + 2Ф н = 2лактат + 2АТФ + 2H 2 O.
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания - окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, - дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы.
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецифичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы - глюкозо-6-фосфат (Г-6-Ф ):
Для протекания реакции необходимо наличие в среде ионов Mg 2+ , с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза .
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы.
Печёночный изофермент гексокиназы - глюкокиназа - имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2 ) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф ):

Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3 ) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ ) на две триозы (4 ).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.

Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:

В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат , причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5 ), который и участвует в дальнейших превращениях:

Каждая молекула глицеральдегидфосфата окисляется НАД + в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглице-рата (6 ):

Далее с 1,3-дифосфоглицерата , содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7 ) - образуется молекула АТФ:

Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3 . Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфо-глицерат (8 ):

Енолаза образует фосфоенолпируват (9 ):

И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10 ):

Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10 , в которых и происходит к субстратное фосфорилирование АДФ .
Регуляция гликолиза
Различают местную и общую регуляцию.
Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки.
Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм.
Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза.
Инсулин стимулирует гликолиз через:
- · активацию гексокиназной реакции;
- · стимуляцию фосфофруктокиназы;
- · стимуляцию пируваткиназы.
Также на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоныявляются стимуляторами.
Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой (1 ), фосфофруктокиназой (3 ) и пируваткиназой (10 ) отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что позволяет им быть эффективными точками регуляции гликолиза .
Гликолиз - катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтезааланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках .
Синтез АТФ из АДФ и неорганического фосфата, сопряженный с переносом протонов и электронов по дыхательной цепи от субстратов к кислороду, называется окислительным фосфорилированием .
Для количественного выражения окислительного фосфорилирования введен коэффициент окислительного фосфорилирования, который представляет собой отношение числа молекул неорганического фосфата, перешедших в состав АТФ в процессе дыхания, на каждый поглощенный атом кислорода . Отношение Р/О для полной дыхательной цепи равно 3, для укороченной – 2.
Энергия окисления, достаточная для образования молекулы АТФ выделяется в ЦПЭ в следующих стадиях: 1) НАД - ФМН (НАДН-дегидрогеназа); 2) цит b - цит с (убихинол- цитохром с редуктаза); 3) цит а - 1/2 О 2 (цитохром с -оксидаза). На этих стадиях изменения ОВП превышают 0,22 В, что достаточно для образования макроэргической связи АТФ (>30,2 кДж/моль). Уменьшение свободной энергии, сопровождающее перенос протонов и электронов на кислород в результате одного дегидрирования, составляет примерно 220 кДж/моль. При этом на синтез АТФ в полной дыхательной цепи может быть израсходовано 30,2×3=90,6 кДж/моль. Отсюда КПД ЦПЭ около 40%. Остальная энергия рассеивается в виде тепла (поддержание температуры тела).
Известны три основных гипотезы окислительного фосфорилирования.
1. Механохимическая, или конформационная (Грин, Бойер, 60-е гг. ХХ в.). В процессе переноса протонов и электронов изменяется Конформация белков-ферментов. Они переходят в новое богатое энергией состояние, а затем при возвращении в исходную конформацию отдают энергию для синтеза АТФ. Гипотеза частично подтверждена: Еокисл.→ Еконформ. сдвигов → Е АТФ.
2. Гипотеза химического сопряжения (Липман, Слейтер, Ленинджер, 30-40-е гг. ХХ в.). В сопряжении дыхания и фосфорилирования участвуют сопрягающие вещества, например вещество Х. Вещество «Х» акцептирует протоны и электроны от первого фермента в пункте сопряжения, взаимодействует с Н 3 РО 4 . В момент отдачи протонов и электронов второму ферменту пункта сопряжения связь становится макроэргической. Далее макроэрг передается на АДФ с образованием АТФ. До настоящего времени не выделены сопрягающие вещества.
3. Хемиосмотическая гипотеза П.Митчелла (1961). По современным представлениям дыхание и фосфорилирование связаны между собой электрохимическим потенциалом (ЭХП) на внутренней мембране митохондрий. Для объяснения необходимы следующие понятия: а) внутренняя мембрана митохондрий непроницаема для Н + и ОН - ; б) во внутреннюю мембрану митохондрий вмонтирована АТФ-синтаза, катализирующая обратимую реакцию: АТФ + Н 2 О « АДФ + Рн. АТФ-синтаза состоит из следующих субъединиц: F 0 – гидрофобный сегмент из 13 полипептидных цепей, связанный с внутренней мембраной митохондрий; F 0 – это протонный канал, по которому в норме только могут перемещаться протоны через мембрану; F 1 – сопрягающий фактор, катализирующий синтез АТФ при перемещении протонов. В укороченной цепи переноса электронов отсутствует только первый этап, остальной перенос электронов такой же, как и в полной цепи; в) синтез АТФ осуществляется при перемещении протонов через АТФ-синтазу в направлении от ММП (межмембранное пространство) к матриксу.
Суть окислительного фосфорилирования: за счет энергии переноса электронов в ЦПЭ (Е окисления) происходит движение протонов через мембрану в ММП и создается электрохимический потенциал (Е ЭХП). При возвращении протонов назад через АТФ-синтазу энергия ЭХП трансформируется в энергию АТФ – Е АТФ. Итак: Е Окисл. ® Е ЭХП ® Е АТФ.
НАДН-КоQ редуктаза, цитохром редуктаза и цитохромоксидаза выталкивают протоны в межмембранное пространство. Протоны берутся из Н 2 О матрикса или за счет конформационных изменений в ферментах. Со стороны матрикса на мембране будет преобладать отрицательный заряд (избыток ОН -), а со стороны ММП положительный (за счет Н +). Возникает ЭХП, который состоит из двух компонентов: осмотического (разности концентраций ионов Н +) и электрического (разности электрических потенциалов):ΔmН + = Dj + DрН . Эта величина измерена, она равна ~0,25 В (хемиосмотическая гипотеза П.Митчела). При обратном токе протонов через канал АТФ-синтазы (разрядка мембраны) возникает 3 молекулы АТФ в полной ЦПЭ и 2 молекулы АТФ в укороченной. Таким образом внутренняя мембрана митохондрий выполняет роль сопрягающей мембраны. Теперь можно суммировать все строение ЦПЭ в виде 5 ферментативных комплексов, привязав их положение к шкале ОВП (таблица 6.3).
Таблица 6.3
Компоненты митохондриальной цепи переноса протонов и электронов
| ОВП, В | Компоненты ЦПЭ |
| -0,4 | Субстраты 2 и 3 рода |
| -0,3 | Комплекс I (полная ЦПЭ) |
| НАДН-дегидрогеназа (КФ 1.6.5.3.). 700-800 кДа, 25-30 субъединиц, 1 ФМН, 2 Fe 2 S 2 , 4-5 Fe 4 S 4 | |
| ~0 | Субстраты I рода |
| Комплекс II (укороченная ЦПЭ) | |
| Сукцинатдегидрогеназа (КФ 1.3.5.1.). 125 кДа, 4-6 субъединиц, 1 ФАД, 1 Fe 2 S 2 , 1Fe 4 S 4 , 1 Fe 3 S 4 , 2 убихинона, 1 гем цитохрома b | |
| Комплекс III (обе ЦПЭ) | |
| Убихинол-цитохром с -редуктаза (КФ 1.10.2.2.). Около 400 кДа, 11 субъединиц, 2 Fe 2 S 2 , 2 гема цитохрома b , 1 гем цитохрома с 1 | |
| +0,3 | Комплекс IV (обе ЦПЭ) |
| Цитохром с -оксидаза (КФ 1.9.3.1.). Около 200 кДа, 8-13 субъединиц, 2 Cu, 1 Zn, 1 гем цитохрома а и 1 гем цитохрома а 3 | |
| Комплекс V (обе ЦПЭ при сопряжении дыхания и фосфорилирования) | |
| Н + -транспортирующая АРФ-синтаза (КФ 3.6.1.34.). Больше 400 кДа, 8-14 субъединиц | |
| +0,8 | Кислород |
Полная ЦПЭ - 1,3,4 и 5 комплексы, укороченная ЦПЭ – 2,3,4 и 5 комплексы.
В англоязычной литературе указывается, что на каждую пару электронов, переносимых от НАДН в межмембранное пространство выталкивается 10 протонов, а при окислении сукцината – 6 протонов. В результате проведенных исследований установлено, что для синтеза 1 молекулы АТФ необходимо 4 протона, 3 из которых используется для образования АТФ, а 1 протон используется для транспорта Рн, АТФ и АДФ через митохондриальную мембрану. Следовательно, если 10 протонов выталкивается в межмембранное пространство, а 4 используется для синтеза АТФ, то коэффициент окислительного фосфорилирования равен 2,5 (10/4) в полной дыхательной цепи и 1,5 (6/4) в укороченной дыхательной цепи. Однако, окончательный вывод можно будет сделать только при полной расшифровке механизма функционирования АТФ-азы.
У некоторых морских бактерий возникновение электрохимического потенциала на мембране связано с возникновением ΔmNa, что определяет синтез АТФ, создание солевых градиентов и движение жгутиков.
Дыхательный контроль – это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/АДФ . Чем меньше это отношение (преобладает АДФ), тем интенсивнее идет дыхание (это обеспечивает реакцию АДФ + Рн ® АТФ). Это видно по увеличению потребления кислорода митохондриями после добавки АДФ (эксперименты Чанса) или по усиленному дыханию бегущего человека.
Вещества, прекращающие поток электронов по дыхательной цепи ферментов, называют ингибиторами дыхания . Ротенон и амитал специфически ингибируют перенос электронов в НАДН-дегидрогеназном комплексе и таким образом предотвращают генерирование протонного градиента в 1-м комплексе. В то же время указанные ингибиторы не нарушают окисление сукцината. Антимицин А тормозит ток электронов между цитохромами b и c 1 , предотвращая синтез АТФ, сопряженный с генерированием протонного градиента в 3-м комплексе. Этот блок можно обойти добавлением аскорбата , который непосредственно восстанавливает цитохром с. Наконец, ток электронов может быть блокирован между цитохромоксидазным комплексом и кислородом под действием CN - , N 3 - и СО . В присутствии этих ингибиторов из-за блокирования тока электронов не происходит фосфорилирования, сопряженного с генерированием протонного градиента в 4-м комплексе.
Разобщение дыхания и окислительного фосфорирования возникает при повышении проницаемости мембраны митохондрий для протонов в любом месте, а не только в канале АТФ-синтазы. При этом не создается электрохимический потенциал и энергия окисления рассеивается в виде тепла. Так действуют ионофоры (2,4-динитрофенол, валиномицин и др.). Они переносят обратно протоны через мембрану, выравнивая градиенты рН и мембранного потенциала. Лекарственные препараты (аминобарбитал ), продукты жизнедеятельности микроорганизмов, избыток тиреоидных гормонов (вызывают накопление ненасыщенных жирных кислот, являющихся ионофорами) и др. приводят к разобщению дыхания и фосфорилирования, обеспечивая гипертермию.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Тканевое дыхание, протекающее в митохондриях и не сопровождающееся образованием макроэргов, называют свободным или нефосфорилирующим окислением .
Природным разобщающим агентом является термогенин , протонный канал в митохондриях бурых жировых клеток. Бурый жир обнаружен у новорожденных и животных, впадающих в зимнюю спячку и служит для теплообразования. При охлаждении организма норадреналин активирует гормонзависимую липазу. Благодаря активному липолизу в организме образуется большое количество свободных жирных кислот, которые распадаются в результате β-окисления и в дыхательной цепи. Так как жирные кислоты одновременно открывают протонный канал термогенина, их распад не зависит от наличия АДФ, т.е. протекает с максимальной скоростью и генерирует энергию в форме тепла.
Образованная в результате окислительного фосфорилирования в митохондриях АТФ обменивается на внемитохондриальную АДФ с помощью специальных белков транслоказ (транслоказы составляют до 6% от всех белков внутренней мембраны митохондрий).
Гипоэнергетические состояния возникают 1) при нарушении поступления субстратов для дегидрирования (на всех этапах от пищи до матрикса митохондрий); 2) при нарушении поступления О 2 в митохондрии (на всех этапах от дыхания, связь с кислорода с гемоглобином, транспорт и пр.); 3) при нарушении мембран митохондрий, композиции липидного бислоя и ферментативных ансамблей внутренней мембраны митохондрий. Предложено вычислять энергетическое состояние клетки , вычисляя «заполнение» системы АТФ-АДФ-АМФ макроэргами. Если все три компонента представлены АТФ, то система энергетически полностью заполнена и ее энергетический заряд равен 1,0. Если же система представлена только АМФ, то ее энергетический заряд равен 0.
Энергетический заряд клетки является важной величиной, определяющей соотношение катаболических и анаболических процессов в ней. В тканях животных важную регуляторную роль выполняет величина отношения АТФ/АДФ.
В сутки человек потребляет в среднем 27 моль кислорода. Основное его количество (примерно 25 моль) используется в митохондриях в ЦПЭ. Следовательно, ежесуточно синтезируется 125 моль АТФ, или 62 кг (при расчете использован коэффициент Р/О = 2,5, т.е. среднее значение коэффициента фосфорилирования). Масса всей АТФ, содержащейся в организме, составляет примерно 20-30 г. Следовательно, каждая молекула АТФ за сутки 2500 раз проходит процесс гидролиза и синтеза.
Молекулярные моторы – это ферменты, трансформирующие химическую энергию гидролиза АТФ в механическую работу (Schliwa M., 2006). В эукариотических клетках выделяют три различных класса моторов: 1) миозин; 2) кинезин и 3) динеин. Для них характерны: 1) протяженная полярная структура, вдоль которой в одном направлении перемещаются актиновые филаменты (миозин) или микротрубочки (кинезины и динеины); 2) молекулярная организация взаимодействующих субъединиц должна обеспечивать однонаправленное движение; 3) связывающие центры для АТФ и подвижных элементов локализуются в глобулярных каталитических доменах, называемых головками; 3) энергию для движения получается при гидролизе АТФ и реализуется через конформационные изменения белков (поворот головки); 5) взаимодействие субъединиц молекулярных моторов обеспечивает перемещение структур в вязкой цитоплазме. В настоящее время известны 18 классов миозинов (мышцы и др. ткани), 10 семейств кинезинов (цитозоль клеток) и 2 группы динеинов (плазма крови). Три типа моторов различаются по молекулярной массе: кинезины – 45 кДа, миозины – 100 кДа и динеины – 500 кДа. По структуре близки кинезины и миозины. Молекулярные моторы используются различными живыми организмами для клеточной активности – контракция, транспорт органелл, подвижность клеток, клеточное деление, передача информации, процессы развития и др.
Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН 2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.
Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом. Согласно этой гипотезе перенос электронов , происходящий на внутренней митохондриальной мембране, вызываетвыкачивание ионов Н + из матрикса митохондрий в межмембранное пространство. Это создает градиент концентрации ионов Н + между цитозолем и замкнутым внутримитохондриальным пространством. Ионы водорода в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу .
По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называютдыхательными ферментами , а последовательность их расположения в мембране – дыхательной цепью (англ. electron transport chain ).
Принцип работы дыхательной цепи
В целом работа дыхательной цепи заключается в следующем:
1. Образующиеся в реакциях катаболизма НАДН и ФАДН 2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
2. Электроны движутся по ферментам дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н + из матрикса в межмембранное пространство.
4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5. Протоны Н + стремятся обратно в матрикс и проходят через АТФ-синтазу.
6. При этом они теряют энергию, которая используется для синтеза АТФ.
Общие принцип окислительного фосфорилирования
Таким образом, восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование . Поэтому весь процесс целиком получил название окислительное фосфорилирование
Дыхательная цепь включает множество белков-переносчиков
Всего цепь переноса электронов (англ. electron transport chain ) включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.

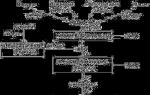
Блок-схема дыхательной цепи
Строение ферментативных комплексов дыхательной цепи
Комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа , содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
Функция
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
Комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты , расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
Функция
1. Восстановление ФАД в окислительно-восстановительных реакциях.
2. Обеспечение передачи электронов от ФАДН 2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q .
Комплекс. КоQ-цитохром с-оксидоредуктаза
Данный комплекс включает цитохромы b и c 1 . Кроме цитохромов в нем имеются 2 железо-серных белка. Всего насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кDа.
Функция
1. Принимает электроны от коэнзима Q и передает их на цитохром с .
2. Переносит 2 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
Комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а 3 , он называется также цитохромоксидаза , всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди.
Функция
1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2. Переносит 4 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
Комплекс
Пятый комплекс – это ферментАТФ-синтаза , состоящий из множества белковых цепей, подразделенных на две большие группы:
· одна группа формирует субъединицу F о (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая , по ней выкачанные наружу протоны водорода устремляются в матрикс.
· другая группа образует субъединицу F 1 – ее функция каталитическая , именно она, используя энергию протонов, синтезирует АТФ.
Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение приблизительно 3-х протонов Н + .
Характеристика компонентов дыхательной цепи (ферментативных комплексов):
1)НАДН-дегидрогеназа (НАДН-КоQ-оксидоредуктаза) – встроена во внутреннюю мембрану митохондрий. Это флавин-зависимый фермент, в состав которого входит витамин В2. , имеет 2 простетические группы: ФМН и Железосерные белки. Функция: а)Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
б) Переносит 4 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
2) КоQ (убихинон ) – небелковый переносчик, является жирорастворимым не заряжен. Поэтому он принимает электроны и протоны с ФАДН2, т.е. ч/з 2й вход в дыхательную цепь.
3) Цитохромы (b, c 1 , c, а, а 3 ) – сложные белки (гемпротеины), небелковой частью которых является гем, содержащийFе 3+ (окисленная форма). Fе гема может обратимо принимать и отдавать электроны.
4) УбихинолДГ (КоQ-цитохром с-оксидоредуктаза) – это ферментный комплекс, состоящий из цитохромов b и с1, включающий также FеS-центры. Функция:
а) Принимает электроны от ко-Q и передает их на цитохром; б)Переносит 2 иона Н + на наружну
5) Цитохром с-кислород-оксидоредуктаза - В этом комплексе находятся цитохромы а и а3, В комплексе также имеется 2 иона меди. Функция: а) Принимает электроны от цитохрома с и передает их на кислород с образованием воды. б)Переносит 4 иона Н + на наружну
6) АТФ-синтаза – комплекс, две большие группы: одна группа формирует субъединицу Fо –по ней выкачанные наружу протоны водорода устремляются в матрикс. Другая группа образует субъединицу F1 –используя энергию протонов, синтезирует АТФ.
Сопряжение в дыхательной цепи - это такое состояние, когда окисление (перенос электронов) сопровождается фосфорилированием, то есть синтезом АТФ.
Разобщение - это состояние дыхательной цепи, когда окисление идет, а фосфорилирование не происходит, то есть пункты фосфорилирования выключены.Е в виде тепла. Разобщение вызывают липофиль-ные вещества, которые способны переносить протоны водорода с внешней стороны внутренней мембраны митохондрий на внутреннюю, минуя АТФ-синтетазу. 2,4-ДНФ (динитрофенол), яды промышленных производств, бактериальные токсины, набухание митохондрий, жирные кислоты, ионофоры (вещества, переносящие ионы через мембрану). Разобщители повышают скорость переноса электронов по дыхательной цепи и выводят ее из под контроля АТФ.
Выделяют три основных группы ингибиторов:
1. действующие на I комплекс, например, амитал (производное барбитуровой кислоты), ротенон, прогестерон,
2. действующие на III комплекс, например, экспериментальный антибиотик антимицин А,
3. действующие на IV комплекс, например, сероводород (H2S), угарный газ (СО), цианиды (-CN).
Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ.
Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование AДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О = 2.
Дыхательный контроль –Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду.
субстратное фосфорилирование - процесс образования АТФ, не связанный с мембранами. В этом случае АТФ образуется За счет того, что фосфатная группа перемещается от (субстрата) к АДФ (например, образование АТФ при гликолизе).
Этот способ связан с передачей макроэргического фосфата субстрата на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем 7,3 ккал/моль в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ.
Отличия : разные источники энергии, для окислительного необходимы движение электронов в дых цепи, для субстратного необ-ма энергия макроэргической связи.оксилительное на мембране митохондрий, субстратное в цитозоле,
Существует три основных способа использования АТФ: 1. биосинтез веществ, 2. транспорт веществ через мембраны,
3. изменение формы клетки и ее движение. Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл :
Использование
АТФ как источника Е возможно только при
условии непрерывного синтеза АТФ из
АДФ за счёт Е окисления орг-их соединений.
Цикл АТФ-АДФ - основной механизм обмена
энергии в биологических системах.

свободное окисление , не сопряженное с синтезом АТФ: микросомальное (в гладком эндоплазматическом ретикулуме) и пероксисомалъное. Основная роль свободного окисления - пластическая и антитоксическая: гидроксилирование углеводородных компонентов, в том числе ароматических; синтез стероидных гормонов и желчных кислот; обезвреживание токсинов и т.д. В свободном окислении участвуют особые флавиновые ферменты и цитохромы Ь; и Р450. Процессы свободного окисления сосредоточены в цитозоле, в мембране эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. Они идут также в ядерном аппарате клетки.
Тканевые и возрастные особенности окислительных процессов. Анаэробные ткани могут получать энергию без кислорода. Такими тканями являются: скелетные мышцы, эритроциты, периферические нервы, мозговое вещество почек, кость, хрящ, соединительная ткань. Аэробные ткани получают энергию с использованием кислорода и полностью зависят от кровотока. К таким тканям относятся: головной мозг, сетчатка глаза, сердце, кора почек, печень, слизистая тонкого кишечника. Потребление кислорода, а значит, и интенсивность окислительных процессов с возрастом падают.
Углеводы - это оксопроизводные многоатомных спиртов и продукты их конденсации.
Функции углеводов:
1. Углеводы служат источником энергии 17,18 кДж).
2. Углеводы входят в состав структурно функциональных компонентов клеток. К ним относятся пентозы нуклеотидов и нуклеиновых кислот, углеводы гликолипидов и гликопротеинов
3. Из углеводов могут синтезироваться соединения других классов (липиды и аминокислоты).
4. Выполняют структурообразовательную функцию, то есть входят в состав клеточных и межклеточных структур
5 специфическиеф функции (как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д.).
Потребность в углеводах взрослого организма составляет 350-400 г в сутки, при этом целлюлозы и других пищевых волокон должно быть не менее 30-40 г.
Ферменты участвующие в переваривании углеводов:
А-амилаза слюны и А-амилаза поджелудочной железы. Эти ферменты расщепляют А-1-4-гликозидные связи в крахмале и гликогене, действуют в слабощелочной среде,активируются ионами хлора
Амило-1,6-гликозидаза вырабатывается в кишечнике и расщепляет 1,6 гликоидные связи в крахмале и глиикогене
Сахараза образуется в кишечнике и расщепляет сахарозу с образованием глюкозы и фруктозы
Мальтаза образуется в кишечнике и расщепляет мальтозу на 2 молекулы глюкозы
Лактаза образуется там же, расщепляет лактозу с образованием галактозы и глюкозы.
углеводы
в жкт расщепляются до моносахаридов-
глюкозы.фруктозы и галактозы, которые
всасываются путем активного транспорта
или диффузно и попадают в кровь, а затем
в печень 1.фруктоза через спец. белки
переносчики фруктозы 2.глюкоза лиюо
через переносчики глюкозы, либо чеое
натрий-зависимые белок-переносчики,3.галактоза
через натриевые переносчики

Нарушение этого процесса может возникать: 1) при поражении поджелудочной железы и слизистой кишечника; 3) отравлениях ферментными ядами
4) Недостаточной выработке дисахаридаз кишечника: лактазы, сахаразы, мальтазы и изомальтазы
. Приобретенная недостаточность . заболевания стенок ЖКТ: энтериты, колиты, когда нарушается образование ферментов. ухудшается всасывание моносахаров. Наследственная недостаточность. При наследственной (первичной) патологии лактазы симптомы проявляются после первых кормлений. Патология сахаразы обнаруживается при введении в рацион сладкого. Недостаточность лактазы может проявляться не только у младенцев, но и в подростковом и взрослом возрасте, что является физиологическим возрастным изменением.
Роль печени в обмене углеводов
1 унификация моносахаридов
2 гликогенная функция при избытке глюкозы в крови, в печенипроисходит синтез гликогена
3 синтез углеводов из метаболитов неуглеводного характера(глюконеогенез0
4 синтез гликопротеинов крови
5 образование глюкуроновой кислоты которая участвует в обезвреживании токсинов(билирубина)
 синтез1
- глюкокиназа или гексокиназа; 2 -
фосфоглюкомутаза; 3 - УДФ-глюкопирофосфорилаза;
4 - гликогенсинтаза 5 - фермент «ветвления»
(амило-1,4→ 1,6-глюкозилтрансфераза),
светлые и заштрихованные кружки -
глюкозные остатки, закрашенные кружки
- глюкозные остатки в точке ветвления.
синтез1
- глюкокиназа или гексокиназа; 2 -
фосфоглюкомутаза; 3 - УДФ-глюкопирофосфорилаза;
4 - гликогенсинтаза 5 - фермент «ветвления»
(амило-1,4→ 1,6-глюкозилтрансфераза),
светлые и заштрихованные кружки -
глюкозные остатки, закрашенные кружки
- глюкозные остатки в точке ветвления.
распад гликогена гликогенолиз двумя путями:гидролитический путь в лизосомах поддействием гамма амилазы при участии воды без образования промежуточных метаболитов и фосфоролитический путь(фосфоролиз):

Закрашенный кружок - глюкозный остаток, связанный α-1,6-гликозидной связью; светлые и заштрихованные кружки - глю-козные остатки в линейных участках и боковых ветвях, связанные а-1,4-гликозидной связью. 1 - гликоген-фосфорилаза; 2 - олигосахаридтрансфераза; 3 - α-1,6-глюкозидаза.
Печень запасает глюкозу в виде гликогена для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани
функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;
*синтез гликогена - процесс эндергонический. Так на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;
синтез усиливается инсулином а распад катехоламинами глюкагоном глюкокортикостероидами цАМФ и Са.
Гликогенозы. нарушен распад гликогена. Гликоген накапливается в клетках в больших количествах, что может привести к их разрушению. симптомы: увеличение размеров печени, мышечная слабость, гипогликемия натощак. Известно несколько типов гликогенозов. Они могут быть вызваны недостаточностью глюкозо-6-фосфатазы, фосфорилазы или-ами-лазы.
Агликогенозы вызываются недостаточностью ферментов, участвующих в синтезе гликогена. В результате нарушается синтез гликогена и снижается его содержание в клетках. Симптомы: резкая гипогликемия натощак, особенно после ночного перерыва в кормлении. Гипогликемия приводит к отставанию в умственном развитии. Больные погибают в детском возрасте.
Гликолиз - это расщепление глюкозы до молочной кислоты в анаэробных условиях.
Гликолиз состоит из двух стадий: подготовительной и главной.
В подготовительной стадии глюкоза расщепляется с образованием диоксиацентонфосфата (ДОАФ) и 3-фосфоглицеринового альдегида, при этом рас-ходуются 2 молекулы АТФ;
В главной стадии фосфотриозы превращаются в лактат (молочную кислоту), при этом образуются 4 молекулы АТФ. Синтез АТФ в гликолизе происходит путем субстратного фосфорилирования.
Таким образом, анаэробное окисление глюкозы приводит к образованию 2 молекул лактата и 2 молекул АТФ.
Ключевыми ферментами гликолиза являются: гексокиназа (начальный фермент), фосфофруктокиназа (лимитирующий фермент), пируваткиназа. АТФ и цитрат ингибируют фосфофруктокиназу, АДФ - активирует.
Преимущества гликолиза:
Быстрый процесс;
Анаэробный.
Недостатки гликолиза:
Малоэффективный процесс;
Продуктом гликолиза является лактат, накопление которого в клетках и в крови вызывает метаболический ацидоз

С 6 Н 12 0 6 + 2 Н 3 РО 4 + 2 АДФ = 2 С 3 Н 6 О 3 + 2 АТФ + 2 Н 2 О.
значение:
Анаэробный гликолиз, несмотря на небольшой энергетический эффект, является основным источником энергии для скелетных мышц в начальном периоде в условиях, когда снабжение кислородом ограничено. Кроме того, зрелые эритроциты извлекают энергию за счет анаэробного окисления глюкозы, потому что не имеют митохондрий
Под действием лактатдегидрогеназы молочная кислота окисляется снова, образуя пируват, который и участвует в дальнейших превращениях. . Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО 2 и Н 2 О
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, при О2. Все ферменты локализованы в цитозоле клетки.В аэробном гликолизе можно выделить 2 этапа.
1. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
Таким образом, выход АТФ при окислении 1 моль глюкозы до СО 2 и Н 2 О составляет
38 моль АТФ.
клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Аэробный гликолиз способствует метаболизму клеток опухолей. При высоких нагрузках резко возрастает скорость анаэробного гликогенолиза, конечным продуктом которого является молочная кислота. Энергетически этот процесс примерно в 15 раз менее эффективен, чем аэробный окислительный распад гликогена до Н2О и СО2. Такой путь энергообеспечения мышц играет основную роль при кратковременной работе большей мощности, например при финишных рывках.

читать
снизу вверх!
Ферменты
обратимых реакций гликолиза и
глюконеогенеза: 2 - фосфоглюкоизомераза;
4 - альдолаза; 5 - три-озофосфатизомераза;
6 - глицеральдегидфосфатде-гидрогеназа;
7 - фосфоглицераткиназа; 8 - фосфог-лицератмутаза;
9 - енолаза. Ферменты необратимых реакций
глюконеогенеза: 11 - пируваткарбоксилаза;
12 - фосфоенолпируваткарбоксикиназа; 13
- фрук-тозо-1,6-бисфосфатаза; 14 -
глюкозо-6-фосфатаза. I-III - субстратные
циклы.


2 пируват + 4 ATФ + 2 GTP + 2(NADH) + 4 Н2О Глюкоза + 4 ADP + 2 GDP + 2 NAD+ + 6 Н3РО4.
предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, или один из промежуточных продуктов цикла трикарбоновых кислот. Цикл Кори - совокупность биохимических ферментативных процессов транспорта лактата из мышц в печень, и дальнейшего синтеза глюкозы из лактата, катализируемое ферментами глюконеогенеза.
глюкоза вступает на путь анаэробного гликолиза с образованием лактата. Лактат не может далее окисляться, он накапливается. С током крови лактат поступает впечень. Печень является основным местом скопления ферментов глюконеогенеза, и лактат идет на синтез глюкозы.
Реакция превращения лактата в пируват катализируется лактатдегидрогеназой, далее пируват подвергается окислительному декарбоксилированию
(глюкозо-аланиновый цикл) : глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
Пентозофосфатный путь, служит альтернативным путём окисления глюкозо-6-фосфата. пфп состоит из 2 фаз - окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибуло-зо-5-фосфат, и образуется восстановленный NADPH.
В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пи-римидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.





Роль: Реакции окислительного этапа служат основным источником NADPH в клетках.
энергетическое - метаболиты окислительной части исп.в гликолизе; 2) синтетическое - связано с использованием рибозо-5-фосфата и НАДФН. Рибозо-5-фосфат используется на синтез нуклеотидов, которые необходимы для образования коферментов, макроэргов, нуклеиновых кислот. НАДФН необходим для восстановительных биосинтезов ;для работы гидроксилаз, участвующих в синтезе катехоламинов,;
Регуляция ПФП: ключевыми ферментами - глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа, транскетолаза. Активность ПФП увеличивается при повышении отношения НАДФ + / НАДФН, а также под влиянием инсулина и йодтиронинов. ПФП ингибируют глюкокортикостероиды.
ПФП мало активен в нервной, мышечной и соединительной тканях. ПФП способствует прозрачности хрусталика глаза; предупреждает гемолиз эритроцитов; входит в систему защиты от свободных радикалов и активных форм кислорода.
Концентрация глюкозы в крови поддерживается на постоянном уровне 3,3 - 5,5 ммоль/л. Он обеспечивается двумя противоположно направленными процессами:
1. поставляющими глюкозу в кровь (переваривание углеводов в ЖКТ, ГНГ, распад гликогена печени) и
2. использующими глюкозу в тканях (гликолиз, синтез гликогена, ПФП, синтез жира).
При очень высокой концентрации глюкозы в крови (> 9 – 10 ммоль/л), она может быть снижена за счет выведения ее с мочой. Такое явление называют глюкозурией. В норме концентрация глюкозы в моче составляет 0,2 - 1,2 ммоль/л.
Регуляция: Нервная регуляция концентрации глюкозы в крови выражается в положительном влиянии n.vagus на секрецию инсулина и тормозящем влиянии на этот процесс симпатической иннервации. Кроме этого, выделение адреналина в кровь подвержено симпатическим влияниям.
Основными факторами гормональной регуляции являются глюкагон, адреналин, глюкокортикоиды, соматотропный гормон с одной стороны, и инсулин с другой.
Многие ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты.
Глюкагон повышает содержание глюкозы крови:
Увеличивая мобилизацию гликогена через активацию гликогенфосфорилазы,
Стимулируя глюконеогенез
Адреналинвызывает гипергликемию:
Активируя мобилизацию гликогена
Глюкокортикоиды повышают глюкозу
За счет подавления перехода глюкозы в клетку,
Стимулируя глюконеогенез
Причины гипергликемии:1) алиментарная (пищевая); 2) сахарный диабет (возникает при недостатке инсулина); 3) патология ЦНС (менингит, энцефалит); 4) стресс; 5) избыток гипергликемических гормонов; 6) повреждение поджелудочной железы. Длительная гипергликемия приводит к истощению запасов инсулина, потере воды тканями, поступлению ее в кровь, увеличению кровяного давления, увеличению диуреза. Гипергликемия в 50-60 ммоль/л может привести к гиперосмолярной коме.
Длительная гипергликемия приводит к неферментативному гликозилированию белков плазмы крови, почечных канальцев, нейронов, изменяет их свойства, что является причиной тяжелых осложнений: тканевых гипоксий, катаракты, почечной недостаточности,
Гипогликемия - это снижение концентрации глюкозы в крови.
Причины гипогликемии: 1) пищевая; 2) при тяжелой мышечной работе; 3) воспалительные процессы жкт); 4) патология печени; 5) патология ЦНС; Гипогликемияприводит к гипогликемической коме.
Сахарные нагрузки и сахарные кривыеиспользуют для диагностики сахарного диабета. Обследуемому даётся р-р глюкозы из расчета 1гм на 1кг массы тела. Концентрацию глюкозы измеряют сначала на тощак, а потом в течении 2-3х часов с интервалом в 1ч. По результатам строятся сахарные кривые.
Пределы конц жиров в крови:Норма-4-8г/л, если больше-гиперлипемия(при сах диабете, ожирении). В норме концентрация жиров в кровиколеблется в довольно широких пределах - 10-200 мг/дл, в среднем около 0,1 %.
Липиды – органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
Функции:
1. Резервно-энергетическая функция. 9,3 кКал Е. Является резервом эндогенной воды 1,7г воды
2. Структурная функция. Мембраны клеток состоят из фосфолипидов, обязательным компонентом являются гликолипиды и холестерол.
3. Сигнальная функция. Гликолипиды выполняют рецепторные функции и задачи взаимодействия с другими клетками.
4. Защитная функция . жир
5. Необходимы для растворения и всасывая жирорастворимых витаминов (А, Е, D,K,Q)
6. Являются предшественниками других соединений: глицерин испол-ся на синтез глюкозы, жирные к-ты окисляются до ацетилКоА и могут быть использованы на образование ацетилхолина)
7. Специфические функции: обеспечивают устойчивость эритроцитов, ганглиозиды связывают различные токсины и яды.
80-100 г в сутки жира должно быть
Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием «липазы языка» .
1. Эмульгирование жиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу. используется процесс эмульгирования, когда гидрофобные молекулы (ТАГ, эфиры ХС) погружаются внутрь мицеллы, а гидрофильные остаются на поверхности, обращенной к воде
2. Гидролиз триацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ. Переваривание жиров - гидролиз жиров панкреатической липазой и колипазой.
3. Образование мицелл В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, жирные кислоты и свободный холестерол, формирующие мицеллы. Свободный глицерол всасывается прямо в кровь.
4. Всасывание мицелл.. всасываются . 1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь просто.Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Через водную фазу мицеллы мигрируют к каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты проникают внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
5. Ресинтез триацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах.
Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирных кислот: HS КоА + RCOOH + АТФ → R-CO ~ KoA +АМФ + Н 4 Р 2 О 7 . Реакция катализируется ферментом ацил-КоА-синтетазой (тиокиназой).
ацилтрансфе-раза
2. В клетках слизистой оболочки тонкой кишки всосавшиеся молекулы холестерола также превращаются в эфиры путём взаимодействия с ацил-КоА (рис. 8-17). Эту реакцию катализирует ацил-холестерол-ацил-трансфераза (АХАТ)

В клетках эпителия тонкой кишки из жиров, формируются липопротеиновые комплексы - хиломикроны ХМ далее доставляют жиры в периферические ткани.
Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов - фосфолипидами и холестеролом.
ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани,.
хм большие поэтому идут в лимфу, затем через грудной проток в кровь.
В крови триацилглицеролы, входящие в состав зрелых ХМ, гидролизуются ферментом липопротеин-липазой находящимся на поверхности эндотелиаль-ных клеток, В результате действия ЛП-липа-зы на жиры ХМ образуются жирные кислоты и глицерол.
жирные кислоты в ткани
глицерол в печень
остаточные хиломикроны попадают в гепатоциты посредством эндоцитоза и разрушаются.
Этапы окисления жирных кислот: 1. активироваться в цитозоле.
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ + PPi.
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану,и он заходит в комплексе с карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
3. После св-ия с карнитином ж к-та переносится ч/з мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь обр-ет ацил-S-КоА вступает на путь β-окисления.
4.
Процесс собственно β-окисления состоит
из 4-х реакций, повторяющихся циклически.

образовавшийся фадН2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ
Восстановленный NADH,окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ
Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С 15 Н 31 СО-КоА + 7 FAD + 7 NAD + + 7 HSKoA →
8 CH 3 -CO-KoA + 7 FADH 2 + 7 (NADH + H +).131-2 на активацию жк=129атф
Глицерин – трехатомный спирт, водорастворим и легко всасывается из кишечника и по воротной вене поступает в печень.Окисление глицерина
 Фосфоглицериновый
альдегид далее может окисляться до
пировиноградной и молочной кислоты.
Фосфоглицериновый
альдегид далее может окисляться до
пировиноградной и молочной кислоты.
Е значение в-окисление имеет для скелетных мышц (50% Е), для сердечной мышцы (70%), головной мозг и другие нервные ткани, а также эритроциты не используют жирные к-ты для окисления; они не поступают в головной мозг, т.к. не проходят ч/з гематоэнцефалический барьер.
Физиологическое значение окисления жирных кислот в зависимости от ритма питания и мышечной активности.
Липолиз - это расщепление жира до глицерина и ЖК. Катализируется триглицеридлипазой, диглицеридлипазой и моноглицеридлипазой. Триглицеридлипаза является лимитирующим ферментом липолиза. Она имеет две формы: фосфорилированIную (активную) и нефосфорилированную (неактивную).
Превращение неактивной формы в активную происходит под влиянием протеинкиназы. Протеинкиназа, в свою очередь, активируется в результате присоединения к ее аллостерическим центрам цАМФ.Регуляция липолиза происходит под действием гормонов.Активируют липолиз: катехоламины, глюкагон, СТГ, АКТГ, тироксин, липотропин гипофиза, цАМФ.Ингибирует липолиз инсулин.Липогенез - это синтез жира. Для синтеза жира необходимы глицерин и ЖК в активных формах. Активной формой глицерина является 3-фосфоглицерол (α-глицерофосфат), ЖК - ацил-КоА.
В жировой ткани 3-фосфоглицерол образуется из ДОАФ (метаболит гликолиза) путем гидрирования под действием глицерофосфатдегидрогеназы с затратой НАДН. В печени и почках 3-фосфоглицерол образуется путем фосфорилирования глицерина под действием глицеролкиназы с затратой АТФ.Ацил-КоА образуется при взаимодействии ЖК НSКоА с затратой АТФ под влиянием ацил-КоА-синтетазы. Сборка триглицерида происходит из 3-фосфоглицерола и ацилов-КоА под действием ацилтрансферазы.Ингибируют липогенез КА, СТГ, ЙТ, АКТГ, АДФ.Активируют - инсулин, эстрогены и АДФ.
1.
Образование ацетил-КоА и его транспорт
в цитозоль(на схеме начинать с оксолацетата
справа!!! заканчивать оксолацетатом
слева)

1 - цитрат-синтаза; 2 - транслоказа; 3 - цитратлиаза; 4 - малатдегидрогеназа; 5 - малик-фермент.
2. Образование малонил-КоА из ацетил-КоА (ацетил-КоА-кар-боксилаза)
После образования малонил-КоА синтез жирных кислот продолжается на мультифер-ментном комплексе - синтазе жирных кислот (пальмитоилсинтетазе)он последовательно удлиняет радикал жирной кислоты на 2 углеродных атома, донором которых служит малонил-КоА. Конечный продукт работы этого комплекса - пальмитиновая кислота
Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА имеет следующий вид:(7 циклов)
CH 3 -CO-SKoA + 7 HOOC-CH 2 -CO-SKoA + 14 (NADPH + H +) → C 15 H 31 COOH + 7 CO 2 + 6 H 2 O + 8 HSKoA + 14 NADP + .
Регуляторный фермент синтеза жирных кислот - ацетил-КоА-карбоксилаза. Этот фермент регулируется несколькими способами.
Основной продукт элонгации в печени - стеариновая кислота (С18:0),
Включение двойных связей в радикалы жирных кислот называется деса-турацией. Основные жирные кислоты, образующиеся в организме человека в результате десатурации - пальмитоолеино-вая (С16:19) и олеиновая (С18:1Δ9).
Для образования двойной связи в радикале жирной кислоты требуется молекулярный кислород, NADH, цитохром b 5 и FAD-зави-симая редуктаза цитохрома b 5 . Атомы водорода, отщепляемые от насыщенной кислоты, выделяются в виде воды. Один атом молекулярного кислорода включается в молекулу воды, а другой также восстанавливается до воды с участием электронов NADH, которые передаются через FADH 2 и цитохром b 5 .
Регул:Ассоциация/диссоциация комплексов субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы, каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат; он стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА; он вызывает диссоциацию комплекса и снижение активности фермента
АцетилКоА - это центральный метаболит липидного обмена.
Источники: 1)Глюкоза 2)глицерин 3)АК (при кратковременной напряженной мышечной работе) 4)Жирные к-ты (в-окисление при длительной мышечной работе, голодании, на холоде, при беременности и сахарном диабете).
Пути использования образовавшегося ацетилКоА зависят от функционального состояния клетки и ее специфики. Если в кл достаточно АТФ, то он используется на синтез ж к-т,т.к. АТФ активирует ключевой фермент ситеза ж к-т, а их накопление стимулирует синтез жира. Распад жира тормозится и в-окисление при этом тоже тормозится. Напряженная мышечная работа, стресс, увел-ие секреции катехоламинов активирует липолиз, в-окисление ж к-т; в этом случае актив-ся синтез кетоновых тел и ЦТК.
Пути использования: 1. окисляется в цикле Кребса(90%); 2.используется в синтезе ЖК (9%) 3. Образование В-гидрокси-в-метилглутарилКоА (а из него либо холестерин, либо кетоновые тела -1%)
К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон.
Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления.
В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное кетоновое тело в крови - именно β-гид-роксибутират.

Диктовать реакциями!
ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови
ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А.
Если поступление жирных кислот в клетки печени уменьшается, то увеличивается концентрация свободного КоА,ингибирующего фермент.
В норме в крови кол-во КТ 1-3 мг, в моче 40мг. При сахарном диабете 10-50 мг в моче. Накопление кетоновых тел в организме называется кетозом.Он сопровождается кетонемией и кетонурией. Физиологиеский кетоз – при голодании, тяжелой мышечной работе, у новорожденных. Патологический – при сахарном диабете.
При тяжелых формах сахарного диабета до 20 ммоль/л.. накопление кт приводит к сдвигу pH в кислую сторону. Кетоацидоз
холестерин (Холестерол) представляет собой одноатомный спирт
.Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий из митохондрий в составе цитрата. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН
3. После объединения трех молекул изопентенилдифосфата синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
6. Удаление лишних метильных групп , восстановление и изомеризация молекулы приводит к появлению холестерола.
Диктовать реакциями!!
Регуляция
синтеза.
Регуляторным
ферментом является
гидроксиметилглутарил-SКоА-редуктаза,

1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент ингибируется конечным продуктом реакции – холестеролом.
2. Ковалентная модификация при гормональной регуляции: инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Биологическая роль:
1)В печени из него синт-ся желчные к-ты, необходимые для эмульгирования жира, активации липазы и всасывания переваренных продуктов;
2)Под действием УФ-лучей в подкожной жировой клетчатке обр-ся витамин Д;
3) В эндокринных железах из холестерина образуются в коре надпочечников ГКС, минералокортикоиды, слабые эстрогены и андрогены
4)Холестерин входит в состав всех плазматических мембран
Атеросклероз – это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка
1обрат стадия – повреждение эндотелия На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости
2обрат стадия – стадия начальных изменений. модификация липопротеинов в зоне воспаления,
3необрат стадия – стадия поздних изменений. проявл-ся как выступание поверхности в просвет сосуда.
4необрат стадия – стадия осложнений. и возможно разрыв сосуда.
К факторам риска относят: высокое содержание холестерина в крови; наличие сахарного диабета, гипертонии, ожирения; курение, наследственность, пожилой возраст, мужской пол.
липиды являются гидрофобными молекулами и они транспортируются в крови в составе– липопротеинов.
Поверхность липопротеиновой частицы гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Белки в липопротеинах обычно называются апобелками
Липопротеины очень низкой плотности:
Синтезируются в печени из эндогенных и экзогенных липидов,
8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов
В норме концентрация 1,3-2,0 г/л,
Функция: Транспорт ТАГ от печени в ткани, запасающие и использующие жиры
Метаболизм:
3. Аналогично хиломикронам, на эндотелии капилляров ЛПОНП подвергаются воздействию липопротеинлипазы,с образованием свободных жирных кислот и глицерина. Жирные кислоты перемещаются в клетки органов, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани.
4. Остаточные ЛПОНП либо эвакуируются в гепатоциты посредством эндоцитоза, либо после воздействия на них печеночной ТАГ-липазы превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП).
Липопротеины низкой плотности:
Образуются в крови. Состоят из 25% белка и 75% липидов. является холестерин примерно50%. На клеточных мембранах имеются рецепторы для ЛПНППосле узнавания проникают в клетки путем эндоцитоза, там распадаются под действием ферментов гидролаз в лизосомах. холистерин идёт на построение мембран и метаболические нужды клеток. Функция: транспорт холестерина в ткани, в том числе в печени.
Липопротеины высокой плотности (ЛПВП или а-липопротеины):
Состав: 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. В поверхностном слое ЛПВПобразуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ)Далее он транспортируется в печень, где холестерин исп-ся на синтез желчных к-т. ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеидов и транспортируют его в печень, предотвращая накопление его в клетках.
ЛПОНП и ЛПНП считают атерогенными, то есть вызыва¬ющими атеросклероз. ЛПВП - антитиатерогенными.
Повышение липопротеидов называется гиперлипопротеидемией.
Атеросклероз -это патология, которая характеризуется отложением, холестерина в стенке крупных сосудов с образованием вначале пятен, полосок. Затем на их месте образуются утолщения. вокруг него развивается соединительная ткань, затем наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение ткани, а на месте бляшек могут возникать тромбы.
Болезнь Вольмана – аутосомно-рецессивное заболевание из-за дефекта кислой эстеразы лизосом, что обусловливает накопление эфиров холестерола в лизосомах печени, селезенки, надпочечников, костного мозга и тонкого кишечника. Больные умирают в возрасте до 6 мес
.Болезнь Шюллера-Кристиана аутосомно-рецессивное заболевание характеризуется отложением в плоских костях, твердой мозговой оболочке и коже холестерола и его эфиров. Течение заболевания прогрессирующее. Дефектный фермент неизвестен.
1.Структурная.
2.Ферментативная.
3.Гормональная. инсулин и глюкагон.
4.Рецепторная.
5.Транспортная
7.Сократительная. (тубулин, актин, миозин).
8.Защитная. иммуноглобулины крови, белки свертывающей системы
100-120 г белков в сутки.
Пепсин образуется главными клетками желудка в виде препепсина. расщепляет(фенилаланина, тирозина и триптофана). Пепсин действует в сильно кислой среде при рН 1,5 - 2,5.
Гастриксин образуется в желудке, (глутамата и аспартата), действует при рН 3,5.
Трипсин образуется в поджелудочной железе в виде претрипсина. Активируется энтеропептидазой кишечника.действует на связи аргинина или лизина.
Химотрипсин образуется в поджелудочной железе в виде прехимотрипсина. Активируется под действием трипсина. Расщепляет связи, образованные карбоксильными группами ароматических аминокислот.
Эластаза образуется в поджелудочной железе, расщепляет связи образованные пролином.
Коллагеназа образуется в поджелудочной железе, расщепляет коллаген.
Карбоксипептидаза образуется в поджелудочной железе, активируется трипсином, отщепляет аминокислоты с С-конца,.
Аминопептидаза образуется в кишечнике, отщепляет аминокислоты с N-конца.
Дипептидазы образуются в кишечнике и расщепляют дипептиды.
В результате действия вышеперечисленных пептидаз белки расщепляются до аминокислот, которые всасываются стенкой кишечника путем активного транспорта с использованием специфических переносчиков, витамина В 6 и АТФ. Через воротную вену аминокислоты попадают в печень.
Необходима для превращения препепсина в пепсин;
Создает оптимум рН для работы пепсина;
Способствует денатурации и набуханию пищевых белков;
Различают
первичные (при различных формах патологии желудка и кишечника - хронических гастритах, язвенной болезни, раке) и вторич¬ные или функциональные расстройства секреторной и всасывательной функции эпителия в результате отека слизистой оболочки желудка и ки¬шечника, нарушения. причины недостаточного расщепления белков -уменьшение секреции соляной кислоты и ферментов, снижение активности протеолитических ферментов и связанное с этим недостаточное образование аминокислот, ускорение перистальтики. если мало НСЛ то низкое пн и белки набухшие послабление. белки переходят из желудка в двенадцатиперстную кишку в неизменном состоянии, что затрудняет действие трип¬сина, химотрипсина и других протеолитических ферментов кишечника.
Источники аминокислот
Переваривание пищевых белков в ЖКТ.
Расщепление клеточных белков лизосомальными пептидазами (катепсинами).
Синтез из других аминокислот.
Образование из безазотистых соединений (прежде всего из кетокислот).
Пути использования аминокислот
Синтез белков (это основной путь использования аминокислот).
Синтез биологически важных соединений (пуринов, пиримидинов, гормонов, порфиринов и других).
Дезаминирование аминокислот с образованием кетокислот, которые могут:
Окисляться в цикле Кребса,
Использоваться в ГНГ на синтез глюкозы,
Превращаться в кетоновые тела.
незаменимыми. К ним относят фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
заменимыми. К ним относят глицин, аспарагиновую кислоту, аспа-рагин, глутаминовую кислоту, глутамин, серин, пролин, аланин. аргинин и гистидин тирозин и цистеин

К глюкогенным относятся аминокислоты (их большинство), при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат.
Из гликогенных амиокислот синтезируется глюкоза
аминокислоты с разветвленными боковыми цепочками, частично преобразутся в аминокислотный аланин, В цикле преобразования глюкозы аминокислоты с разветвленной цепочкой являются донорами химических групп для пируватов с последующим образованием аланина. Преобразуясь в глюкозу, аминокислоты участвуют в работе цикла трикарбоновых кислот, вырабатывающего энергию в мышцах.
регуляция:пируват карбоксилаза
В отсутствие ацетил-КоА ферментпочти полностью лишен активности.
Регуляция: Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования
образующиеся
продукты реакции – биогенные амины –
функцию нейромедиаторов (серотонин,
дофамин, ГАМК и др.), гормонов (норадреналин,
адреналин), регуляторных факторов
местного действия (гистамин, карнозин,
спермин и др.).катализируются–
декарбоксилазами аминокислот.
Декарбоксилазы аминокислот состоят из
белковой части, обеспечивающей
специфичность действия, и простетической
группы, представленной пиридоксальфосфатом
(ПФ). 
декарбоксилирование гистидина
гистамин стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
сокращает гладкую мускулатуру лёгких, вызывает удушье;

2.Этаноламин образуется при декарбоксилировании серина. Используется для синтеза холина, ацетилхолина, фосфолипидов (фосфатидилэтаноламина, фосфатидилхолина).
NH2-CH(CH2OH)-COOH NH2-CH2(CH2OH)
декарбоксилирование цистеина меркаптоэтиламин который входит в состав КоА.
В тканях организма путресцин - исходное соединение для синтеза двух физиологически активных полиаминов - спермидина и спермина. Спермин ассоциируется с нуклеиновыми кислотами и предположительно участвует в стабилизации их спиральной структуры, в частности, у вирусов


Значение реакции переаминирования
1. Коллекторная функция, то есть аминогруппы от многих аминокислот собираются в одной форме в виде глутамата;
2. Является источником заменимых аминокислот;
3. В ходе этой реакции аминокислоты превращаются в кетокислоты, которые могут окисляться в цикле Кребса, использоваться в ГНГ или превращаться в кетоновые тела.
4. Аминотрансферазы – фермент, который содержится только в клетках при появлении его в крови можно говорить о некрозах. Аспартатаминотрансфераза-сердце, аланин…-печень
Трансаминирование - реакция переноса а-аминогруппы с аминокислоты на α-кетокисло-ту, в результате чего образуются новая кетокисло-та и новая аминокислота.(меняются местами радикалы)
Реакции катализируют ферменты аминотранс-феразы, коферментом которых служит пиридок-сальфосфат (ПФ) - производное витамина В 6
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глу-тамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат
Сначала должен образоваться глутамат и потом уже новая аминокислота

СООН-СО-СН2-СН2-СО-СООН- кетоглутарат.
СООН-СН(NH2)-CH2-CH2-CO-COOH глутамат
СН3-СН(NH2)-СООН аланин
COOH-CH2-CH(NH2)-COOH аспартат
СН 3 СОСООН, пируват
(HO2C-C(O)-CH2-CO2H) оксолацетат
Непрямое дезаминирование, необходимо потому что Большинство аминокислот не способно де-заминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглу-тарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию.
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегид-рогеназы (кофермент NAD +).
Можно выделить 4 стадии процесса:
Трансаминирование с α-кетоглутаратом, образование глутамата;
Трансаминирование глутамата с оксалоаце-татом (фермент АСТ), образование аспар-тата;
Реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
Гидролитическое дезаминирование АМФ. Перенос аминогруппы от аспартата и синтез
Источники аммиака и пути его обезвреживания
Основные источники аммиака:
1.неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
2.окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
3.дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
4.катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
5.жизнедеятельность бактерий толстого кишечника,
6.распад пуриновых и пиримидиновых оснований – во всех тканях.
Используется на восстановительное аминирование (имеет небольшоезначение);
Используется на образование амидов (аспарагина и глутамина), которые поступают в кровь и переносятся в печень и почки, где под действием глутаминазы и аспарагиназы соответственно расщепляются до глутамата или аспартата и аммиака. В печени аммиак используется на образование карбамоилфосфата, из почек аммиак выводится в виде аммонийных солей с мочой.
В мышцах аммиак используется на образование аланина, который в печени превращается в пируват, используемый в ГНГ для синтеза глюкозы. Образовавшаяся глюкоза поступает в кровь и переносится в мышцы, где превращается в пируват в ходе гликолиза. существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата: синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком.
ОРНИТИНОВЫЙ
цикл

Аргинин
подвергается гидролизу под действием
аргиназы, при этом образуются орнитин
и мочевина. 
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращении
СО 2 + NH 3 + Аспартат + 3 АТФ + 2 Н 2 О → Мочевина + Фумарат + 2 (АДФ + Н 3 РО 4) + АМФ + Н 4 Р 2 О 7
Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой.
Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
Гипераммониемия сопровождается появлением следующих симптомов:
Тошнота, повторяющаяся рвота;
Головокружение, судороги;
Потеря сознания, отёк мозга (в тяжёлых случаях);
Отставание умственного развития (при хронической врождённой форме).
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина.